普通は小さいものほど気体!?
一般に分子には、それ自体が何かにくっつこうとする力(分子間力)があります。分子量の小さな物質ほど分子間力は弱くなります。そして分子同士がくっつく力が弱ければ弱いほど固体⇒液体⇒気体となります。なぜならば、分子間の結合力がしっかり影響を及ぼしている状態が固体、少し影響を及ぼしている状態が液体、ほぼ影響していない状態が気体となるからです。水について(2)でも書いた通り、水分子と分子量がほぼ同等のメタンやアンモニアが常温で気体であり、さらに分子量が大きい窒素や酸素までもが常温で気体なのですから、水分子も常温では気体として存在したほうが自然とも思えます。いったいなぜ”水”は常温で液体なのでしょうか。それは水分子の分子間では分子間力以外のくっつく力が働いていると考えるとつじつまが合います。その結合とは水素結合とよばれているものです。
水素結合とは
水素結合という難しそうな言葉がでてきましたが、実はとても簡単で、図のような+と-が引きあう力です。この結合は分子を形成する分子同士の結合(共有結合など)に比べれば弱い結合ですが、分子間力よりは強く、物質の三態に影響を及ぼすのには十分の強さです。
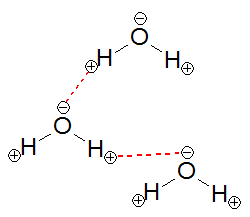
水分子になぜ水素結合が起こるかというと、主に①酸素原子(O原子)と水素原子(H原子)の電気陰性度の違いがある、②この2つの原子が折れ曲がった状態で結合している、ということがあげられます。順に2つの要因を少し詳しく見ていきましょう。
電気陰性度??
電気陰性度と、またもや難しそうな名称がでてきましたが、こちらも難しい話ではありません。大雑把にいえば読んで字のごとく、原子の陰性(マイナス)度合の数値とでも言いましょうか。原子のマイナスの度合いは各原子により異なります。電気陰性度は周期表に記載してある場合もありますが、記載がなくてもweb検索などで簡単に調べることができます。また、周期表の右の方にいけばいくほど(ただし一番右の一列は無視してください)、上にいけばいくほどマイナス度合いが高くなりますので参考にしてください。

”水”の構成元素であるH原子とO原子の電気陰性度を調べるとそれぞれH原子…2.20、O原子…3.44であり、O原子の方がよりマイナス性が強いことがわかります。原子同士が結合する時には電子が関与しますが、電子はマイナスの粒子です。よってH原子とO原子が結合すると、電子はよりマイナス性の強いO原子側にかたよることになります。
このように電気陰性度の違いにより、H原子とO原子の結合には電子のかたよりが生じます。
折れ曲がって結合していると何が違う?
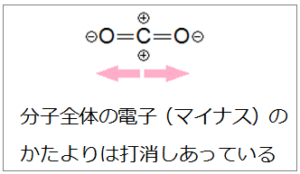
電子のかたよりがあっても図の二酸化炭素(CO2)のようにO原子と炭素原子(C原子)が、直線的な並びでは互いに打消しあって分子全体ではかたよりがなくなります。このような状態は他の分子と結合しなくても安定しています。
ところが水分子のように折れ曲がっていると分子全体で電子のかたよりが生まれます。すると電子がかたよった分子同士でプラスとマイナスが引きあい、他の分子と結合を形成することで安定します。

このように電気陰性度の違いと折れ曲がった結合により水素結合がおこります。水素結合により水分子は常温で液体となるのです。
電子がかたよっていることの利用
更にこの水素結合を形成する、電子のかたよりがあるという特徴は”水”の利用価値を高めています。次回は水分子の電子のかたよりがもたらす水の利便性をみていきます。

